Autor: Ivana Frías, Miembro Aipocrates. Residente de segundo año de la especialidad Genética Médica, Universidad Autónoma de Nuevo León, México

El asesoramiento genético es, ante todo, un proceso de comunicación. Se trata de acompañar al paciente y a su familia en la comprensión y adaptación sobre las implicaciones médicas, psicológicas y sociales de la contribución genética en su padecimiento (Biesecker & Peters, 2018). La Sociedad Nacional de Asesores Genéticos lo define como un proceso que combina la interpretación de antecedentes médicos y familiares, educación sobre herencia y opciones de pruebas genéticas, y apoyo emocional en la toma de decisiones informadas (NSGC, 2012, citado en Stough & Montague, 2014).
Este campo se ha consolidado como un componente esencial de la medicina moderna. Desde la creación del primer programa de formación en Estados Unidos en 1969, la profesión ha crecido de manera sostenida. Hacia 2018 se estimaban unos 7,000 asesores genéticos en 28 países (Ormond et al., 2018); sin embargo, cifras más recientes muestran que en 2022–2023 ya existían más de 10,250 profesionales distribuidos en casi 50 países, con una concentración en América del Norte, pero también con presencia creciente en Europa, Asia, Oceanía y América Latina (Abacan et al., 2024). Este crecimiento responde a la apertura de más de 130 programas de formación, la mayoría a nivel de maestría, y a la expansión de proyectos nacionales de biobancos, tamizaje neonatal y genómica poblacional que requieren asesoramiento como parte integral de la atención.
En este ecosistema, la figura del médico genetista desempeña un papel insustituible. Su formación en medicina le permite integrar la clínica con la biología molecular y otras áreas del conocimiento, lo que le da la capacidad de diagnosticar, interpretar estudios, diseñar planes de manejo y asesorar. Además, aborda tanto al paciente como a sus familiares, porque el riesgo genético trasciende al individuo. En América Latina, donde la figura del asesor genético aún no está consolidada, el médico genetista asume prácticamente toda la carga asistencial.
Desafíos en América Latina
La región enfrenta desigualdades profundas. En México, existen alrededor de 248 genetistas certificados, lo que equivale a un especialista por cada 525,000 habitantes, muy por debajo del estándar internacional de 1 por cada 100,000 (Magaña et al., 2019). En Brasil, la proporción es aún menor, con 1 por cada 770,000 (Díaz Caro & Simone, 2024).
En muchos países, el asesoramiento genético lo brindan médicos generales u otros profesionales sin formación especializada, lo que genera preocupación sobre la calidad y la equidad en el acceso (Díaz Caro & Simone, 2024). Para enfrentar esta brecha, en 2021 se fundó la Sociedad Profesional Latinoamericana de Asesoramiento Genético (SPLAGen), con el objetivo de impulsar la educación, la investigación y las políticas públicas adaptadas a la región (Díaz Caro & Simone, 2024).
El caso colombiano es ilustrativo. En 2015, los servicios de genética existían desde hacía décadas, pero estaban concentrados en alrededor de diez hospitales universitarios o privados, con muy poca cobertura en áreas rurales. Los seguros de salud no incluían de manera rutinaria pruebas moleculares, la enseñanza de genética en las facultades de medicina era variable y muchos médicos carecían de entrenamiento formal para comunicar riesgos. Además, factores culturales como la influencia de la Iglesia Católica condicionaban la práctica en temas sensibles como aborto y diagnóstico prenatal (Vásquez et al., 2015).
Una década después, el panorama muestra avances significativos, pero también persistentes desafíos. Según Páez Rojas et al. (2025), la genética médica se ha consolidado como especialidad clínica reconocida; existen programas de formación, una asociación profesional activa y una mayor incorporación de pruebas genéticas y tratamientos para enfermedades raras en el sistema de salud. La Ley de Tamizaje Neonatal ha fortalecido el diagnóstico temprano, aunque su implementación sigue siendo desigual y algunas pruebas metabólicas permanecen restringidas a proyectos piloto. Asimismo, tecnologías como la secuenciación de nueva generación (NGS) ya se realizan en el país, principalmente en instituciones privadas. Pese a estos avances, los servicios de genética continúan concentrándose en las principales ciudades, la densidad de médicos genetistas sigue siendo baja y persiste la fragmentación entre diagnóstico molecular y atención clínica, lo que limita la equidad en el acceso a la atención genética especializada.
Estos retos muestran que no basta con aumentar especialistas: se necesitan modelos de atención innovadores, capaces de expandir la cobertura y adaptarse a realidades de cada región.
La primera gran innovación: la tele-genética
La tele-genética, definida como la prestación de servicios de asesoramiento genético mediante comunicación electrónica, ya sea en tiempo real o asincrónica, fue la primera gran disrupción (Esplin et al., 2020).
Los beneficios son evidentes: mayor accesibilidad para comunidades rurales, reducción de costos y tiempos de traslado, y resultados de satisfacción comparables a la consulta presencial (Gorrie et al., 2021). Revisiones de más de 18 estudios encontraron que los pacientes consideran la experiencia equivalente al formato tradicional, aunque cerca del 30% sigue prefiriendo la interacción cara a cara (Esplin et al., 2020).
La tele-genética ha demostrado utilidad en múltiples campos: cáncer hereditario, enfermedad de Huntington, glaucoma familiar, cardiopatías, fibrosis quística y hemofilia (Esplin et al., 2020). También han surgido modelos de tele-educación como Project ECHO, que conecta especialistas con médicos rurales para capacitación y co-manejo de pacientes.
Pero persisten limitaciones: la dificultad para interpretar lenguaje no verbal, la necesidad de infraestructura, las barreras regulatorias (licencias, acreditación, privacidad, cobertura de seguros) y la sensación de menor vínculo emocional.
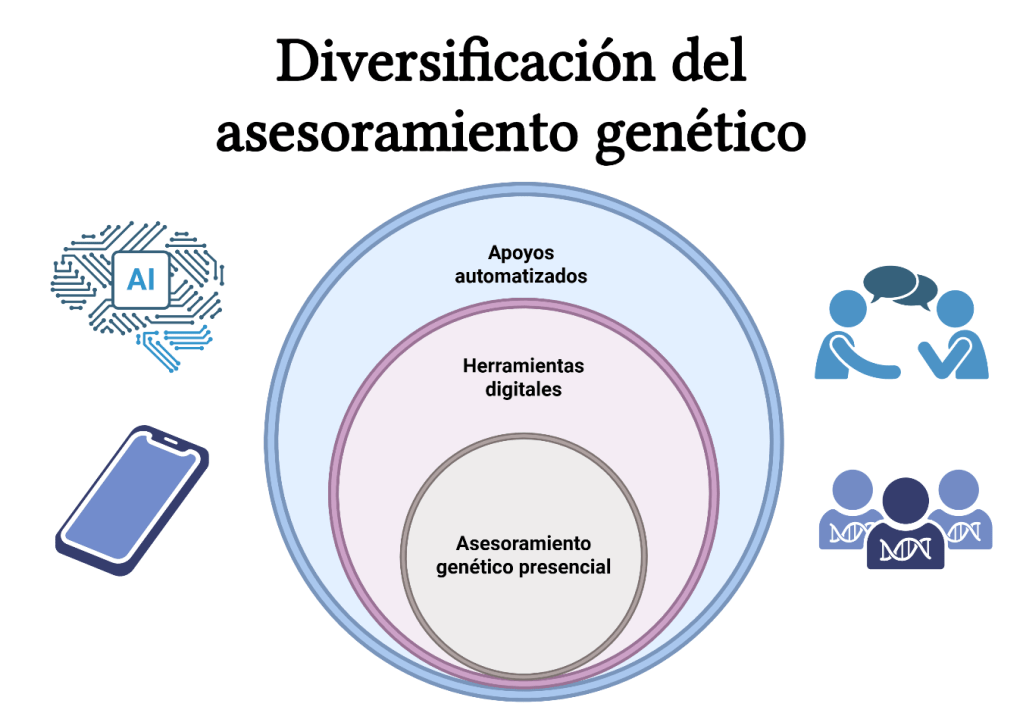
Diversificación del asesoramiento genético
La tele-genética abrió la puerta a un paradigma más amplio: diversificar el asesoramiento genético. Esto implica ofrecer múltiples vías de acceso, combinando presencialidad, herramientas digitales y apoyos automatizados según el contexto.
Entre estas herramientas se incluyen:
- Cuestionarios digitales previos que recaban antecedentes antes de la consulta (Stoll et al., 2022).
- Plataformas educativas y recursos interactivos para explicar conceptos en lenguaje claro (Gorrie et al., 2021).
- Aplicaciones móviles (mHealth) usadas por familias con algún paciente con síndrome de Down, Williams o deleción 22q11.2, que permiten seguimiento clínico (Esplin et al., 2020).
La diversificación también contempla nuevos modelos de servicio impulsados por laboratorios y clínicas privadas, que ofrecen asesoramiento remoto previo y posterior a pruebas moleculares, algunos incluso iniciados por el propio paciente.
Inteligencia artificial y Chatbots
La inteligencia artificial (IA) es otra pieza del rompecabezas. Sus aplicaciones incluyen la interpretación de variantes, el reconocimiento facial en síndromes raros y el desarrollo de chatbots.
El ensayo BRIDGE comparó un chatbot de asesoramiento para cáncer hereditario con la atención estándar, encontrando niveles similares de comprensión y satisfacción (Kaphingst et al., 2024). Este resultado demuestra que los chatbots pueden ser un complemento viable, especialmente para tareas repetitivas o educativas.
Sin embargo, la IA no reemplaza la interacción humana. Como advierte Kearney (2019), automatizar tareas como la construcción de un pedigree puede hacer perder información relacional y emocional clave. La fortaleza de las máquinas está en el manejo masivo de datos; la de los humanos, en la empatía, el contexto y la toma de decisiones centrada en valores. El equilibrio está en integrar ambas dimensiones.
El reto de la secuenciación masiva
La incorporación de la NGS a la práctica clínica ha acelerado diagnósticos y reducido costos, pero también ha multiplicado los dilemas del asesoramiento. Los genetistas deben explicar hallazgos incidentales, variantes de significado incierto y resultados no concluyentes (Espada-Musitu et al., 2025).
Esto plantea nuevos retos éticos: ¿cómo manejar resultados sin opciones terapéuticas? ¿Qué alcance debe tener el consentimiento informado en pruebas pediátricas? La NGS requiere procesos de comunicación más robustos y apoyos digitales que ayuden a las familias a comprender escenarios complejos, sin dejar de lado el acompañamiento psicosocial (Espada-Musitu et al., 2025).
La perspectiva de los pacientes
Las tecnologías digitales no solo impactan a los profesionales; también transforman la experiencia de los pacientes.
Estudios muestran que muchas personas valoran tener acceso directo a sus resultados y la posibilidad de gestionarlos en plataformas digitales, lo que les da autonomía y sensación de control (Hitch et al., 2023). Para algunos, contar con esta información en un “binder (carpeta) digital” fortalece su rol activo en el proceso de atención.
La mayoría de los pacientes expresa confianza en el almacenamiento digital de datos, similar a la que tienen en sistemas bancarios, aunque exigen transparencia: saber quién accede a la información, dónde se guarda y cómo retirarla si lo desean (Shkedi-Rafid et al., 2023).
No obstante, también señalan riesgos: el temor a perder la empatía del vínculo humano y la existencia de brechas digitales que pueden dejar atrás a quienes carecen de conectividad o habilidades tecnológicas.
En general, los pacientes valoran los beneficios de las herramientas digitales: acceso rápido, mejor comunicación entre especialistas y reducción de tiempos de espera, pero advierten que nunca deberían sustituir la interacción con un profesional sensible y empático.
Consideraciones éticas y sociales
La digitalización del asesoramiento genético se apoya de tres promesas: promover la autonomía, aumentar la eficiencia y mejorar la accesibilidad (Bunnik et al., 2025). Sin embargo, la autonomía puede verse limitada si la tecnología dirige implícitamente hacia ciertas decisiones, la eficiencia puede ser ilusoria si requiere constante supervisión, y la accesibilidad puede convertirse en exclusión si persisten desigualdades de alfabetización digital.
Por ello, la integración tecnológica debe ser consciente y ética. Bunnik et al. (2025) proponen cuatro guías:
- Especificar las tareas y beneficios esperados de cada herramienta.
- Identificar desde el inicio los desafíos y sesgos de la digitalización.
- Considerar las necesidades reales de pacientes, familias y profesionales.
- Promover consultas iterativas entre usuarios, clínicos y desarrolladores.
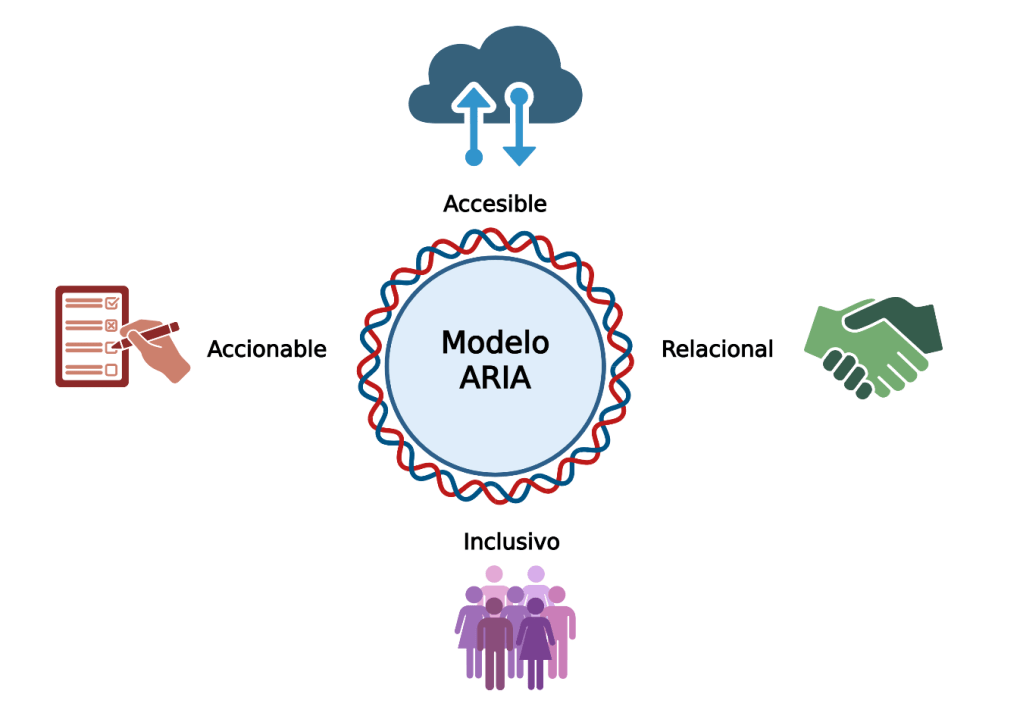
El modelo ARIA: una brújula para el futuro
En este camino hacia la diversificación del asesoramiento genético, resulta especialmente útil el modelo ARIA, propuesto por Joseph y colaboradores (2022) en el marco del proyecto CHARM (Cancer Health Assessments Reaching Many) del consorcio Clinical Sequencing Evidence-Generating Research. Este modelo se diseñó para hacer el asesoramiento más equitativo y efectivo, en particular para comunidades históricamente desatendidas y con baja alfabetización en salud.
Este marco conceptual no solo es útil en los Estados Unidos, donde fue creado, sino que también pudiera ser aplicable en Latinoamérica. Al adaptarlo, puede ayudar a garantizar que la digitalización y la IA no fomenten la desigualdad, sino que fortalezcan la equidad en el acceso al asesoramiento genético. ARIA responde a cuatro principios:
- Accesible: La información genética debe transmitirse en un lenguaje claro, evitando tecnicismos y confirmando la comprensión. Esto es vital cuando se emplean tecnologías digitales, ya que el riesgo de malinterpretación es mayor si no hay supervisión directa. ARIA enfatiza también la necesidad de formatos gráficos, traducciones culturales y ejemplos prácticos para distintos niveles educativos.
- Relacional: El asesoramiento genético no puede reducirse a transmitir datos. La relación de confianza se construye con escucha activa, empatía y validación emocional. En la era digital, este principio nos recuerda que los chatbots o plataformas de IA deben ser un complemento, nunca un sustituto del vínculo humano.
- Inclusivo: La genómica puede ampliar desigualdades si los modelos de atención no consideran diversidad étnica, lingüística y cultural. ARIA propone que cada intervención, sea presencial o digital, incorpore materiales adaptados y mecanismos que reconozcan la pluralidad de los pacientes. Esto incluye el uso de intérpretes, versiones multilingües de materiales educativos y representación equitativa en bases de datos genómicas.
- Accionable: El conocimiento transmitido debe servir para guiar acciones concretas: desde decisiones reproductivas hasta medidas de prevención o vigilancia clínica. En un entorno saturado de información, ARIA subraya que la prioridad no es dar más datos, sino dar datos útiles que las familias puedan transformar en decisiones reales.
Al integrar estos cuatro principios, ARIA se convierte en un parteaguas ético y práctico para navegar la digitalización del asesoramiento genético. Ofrece un marco adaptable tanto en países con sistemas de salud robustos como en regiones con recursos limitados, como gran parte de América Latina. Allí, donde los retos incluyen escasez de médicos genetistas, falta de cobertura de seguros y barreras culturales, el modelo ARIA puede guiar la implementación de tele-genética, chatbots e IA sin perder de vista la equidad y la humanidad.
Conclusión
El futuro del asesoramiento genético no será exclusivamente presencial ni totalmente digital: será híbrido. Cuestionarios y chatbots podrán preparar al paciente antes de la consulta; el genetista seguirá siendo clave en la interpretación compleja y el acompañamiento emocional; y plataformas educativas reforzarán la comprensión después de la cita.
Las tecnologías digitales y la IA ofrecen la oportunidad de ampliar el acceso en regiones con escasez de especialistas, pero solo si se integran bajo principios éticos y centrados en la persona. Porque detrás de cada genoma hay una historia, una familia y una emoción que ningún algoritmo puede replicar.
Diversificar el asesoramiento genético en la era digital significa ampliar horizontes sin perder la esencia: la relación humana. El modelo híbrido, apoyado en los principios de ARIA, puede ser el camino para garantizar que nadie se quede atrás.
Referencias Bibliográficas
- Abacan, M., Ormond, K., Laurino, M., Austin, J., Middleton, A., & Wessels, T. M. (2024). Genetic counseling around the world: A status update. European Journal of Human Genetics, 32(6), 689–698. https://doi.org/10.1038/s41431-024-01675-7
- Biesecker, B. B., & Peters, K. F. (2018). Genetic counseling. In Medical genetics (pp. 1–12). Elsevier.
- Bunnik, E. M., Hofmann, B., & Schickhardt, C. (2025). Digital technologies in genetic counseling: Recommendations for a morally sound integration. Patient Education and Counseling, 108(2), 107–114. https://doi.org/10.1016/j.pec.2025.01.004
- Díaz Caro, C., & Simone, R. (2024). Genetic counseling as a medical specialty in Latin America: Progress and challenges. Molecular Genetics & Genomic Medicine, 12(1), e2203. https://doi.org/10.1002/mgg3.2203
- Esplin, E. D., Foreman, A. K. M., Bowen, D. J., et al. (2020). A randomized clinical trial of telegenetics for cancer genetic counseling. Genetics in Medicine, 22(5), 927–935. https://doi.org/10.1038/s41436-020-0764-y
- Espada-Musitu, M., Ruiz-Sánchez, F., & López-González, M. (2025). Ethical dilemmas in genomic medicine: Counseling challenges in the era of NGS. Frontiers in Public Health, 13, 1035316. https://doi.org/10.3389/fpubh.2025.1035316
- Gorrie, A., Archibald, A. D., & Mendes, M. I. (2021). Benefits and limitations of telegenetics: A literature review. Journal of Genetic Counseling, 30(6), 1471–1482. https://doi.org/10.1002/jgc4.1422
- Hitch, K., Joseph, G., & Cohn, E. (2023). Digital binders for patients in genetic counseling: Perceptions of autonomy and control. Journal of Genetic Counseling, 32(2), 267–276. https://doi.org/10.1002/jgc4.1756
- Joseph, G., Pasick, R. J., Guerra, C., Kinney, A. Y., Biesecker, B. B., & CSER Consortium. (2022). The ARIA model: A framework for equitable communication in genetic counseling. Patient Education and Counseling, 105(4), 902–910. https://doi.org/10.1016/j.pec.2021.11.018
- Kaphingst, K. A., Facio, F. M., & Blout, C. (2024). A randomized trial of a chatbot for hereditary cancer genetic counseling (BRIDGE study). Genetics in Medicine, 26(3), 522–531. https://doi.org/10.1016/j.gim.2024.01.006
- Kearney, H. M. (2019). Genetic counseling in the era of automation: Risks and opportunities. Cold Spring Harbor Perspectives in Medicine, 9(1), a036517. https://doi.org/10.1101/cshperspect.a036517
- Magaña, M. T., Arteaga, C., & Rivas, F. (2019). Workforce in medical genetics in Mexico: Current status and future needs. Revista de Investigación Clínica, 71(4), 225–233. https://doi.org/10.24875/RIC.19003023
- Ormond, K. E., Laurino, M. Y., Barlow-Stewart, K., et al. (2018). Genetic counseling globally: Where are we now? American Journal of Medical Genetics Part C, 178(1), 98–107. https://doi.org/10.1002/ajmg.c.31607
- Páez Rojas, P. L., Mora Barreto, L. M., Rincón Redondo, J. S., Zarante Montoya, I. M., León-Sanabria, M. C., & Urueña-Serrano, A. M. (2025). Strengthening medical genetics and genomic medicine in Colombia: Progress, challenges, and strategic opportunities. Journal of Community Genetics. https://doi.org/10.1007/s12687-025-00826-y
- Shkedi-Rafid, S., Fenwick, A., Dheensa, S., & Lucassen, A. (2023). Patients’ attitudes towards storing and sharing genomic data digitally. European Journal of Human Genetics, 31(4), 475–483. https://doi.org/10.1038/s41431-023-01234-5
- Stoll, K., Kubendran, S., & Cohen, S. A. (2022). The impact of digital family history questionnaires on genetic counseling practice. Journal of Genetic Counseling, 31(1), 56–67. https://doi.org/10.1002/jgc4.1501
- Stough, R. C., & Montague, E. (2014). Genetic counseling definitions and evolving practice. Journal of Genetic Counseling, 23(6), 897–903. https://doi.org/10.1007/s10897-014-9723-1
Vásquez, C., Serrano, N., & González, C. (2015). Genetic counseling in Colombia: A view from the present to the future. Journal of Community Genetics, 6(3), 237–245. https://doi.org/10.1007/s12687-015-0237-4
