Autor: Marco Anaya Taboada. Especialista en Medicina Interna, Nefrología y Trasplante Renal. Máster en Gestión Salud Digital. Miembro Fundador AIpocrates
Desde que recibí mis primeras clases de lectura de electrocardiografía, en VI semestre de medicina, recuerdo varias clases donde nos ensañaban a identificar la morfología y la duración de las ondas, los distintos segmentos e intervalos. Luego la complejidad aumentaba cuando tocaba calcular el eje, identificar los tipos de bloqueos, o identificar una lesión o isquemia y si la localización era subepicárdica o subendocárdica. Además de eso identificar los índices que sugerían crecimiento de las cavidades. Poco a poco fui aprendiendo a leer el electrocardiograma (ECG) metódicamente siempre tratando de identificar hasta el más mínimo detalle.
Con el pasar del tiempo aprendí a ser pragmático y el ejercicio riguroso de la lectura del electro, se redujo a identificar si el ritmo era sinusal o no, si el trazo era o no sugestivo de lesión o isquemia y si había algún otro hallazgo notable que derivara en alguna conducta. Con eso las clases de fisiología cardiaca y del potencial de acción de las células del sistema de conducción, del miocito auricular y del miocito ventricular sin querer fueron quedando un poco en el cajón de los recuerdos.
Con este contexto con el que muchos pudiéramos sentirnos identificados, los invito a que veamos la utilidad del ECG potenciado con la IA (en adelante ECG+IA). La IA ha mejorado significativamente la capacidad de diagnóstico del ECG llegando a niveles que en otro tiempo sería impensados. La IA se entrena analizando grandes conjuntos de datos para encontrar patrones que muchas veces pueden pasar desapercibidos para los humanos, proyectando el ECG, una prueba cardíaca común y no invasiva, en una herramienta de detección temprana no solo de enfermedades cardíacas, sino también de otras enfermedades, incluso en personas asintomáticas, algunas condiciones que mencionaré a continuación:
ECG+IA y determinación de la edad cardiovascular.
¿Qué pensarían si les dijera que el ECG+IA puede establecer el sexo y la edad estimada de acuerdo con su condición cardiovascular? Dicho de otra manera, una persona de 45 años, pero quien, por sus condiciones clínicas y factores de riesgo cardiovascular, ECG+IA identifica que desde el punto de vista cardiovascular tiene 50 años. Sin duda sería una forma de enfocar nuestros esfuerzos involucrando al paciente para acercar la brecha entra estas dos cifras. El modelo ECG+IA fue desarrollado por Attia y cols. basado en red neuronal convolucional, se entrenó con muestras de ECG de cerca de 500,000 trazos de ECG de 12 derivaciones y probado en 275,056 pacientes más, logrando una precisión de 90.4% en la clasificación del sexo y un error medio de 6.9 años en la estimación de la edad. Las discrepancias entre la edad cronológica y la edad predicha por el modelo podría ser el reflejo de condiciones como la hipertensión arterial y la ateroesclerosis coronaria. Incluso Harmon y López-Jiménez reportaron un caso de los cambios en ECG+IA demostraron la disminución de la edad cardiovascular en una mujer con obesidad quien bajo de peso con un régimen de dieta y ejercicio. Estos hallazgos, que, aunque requieren mayor rigurosidad y validación sin duda sería una herramienta complementaria no solo en la identificación de riesgo sino en la trazabilidad con las intervenciones que se realizan en la consulta.
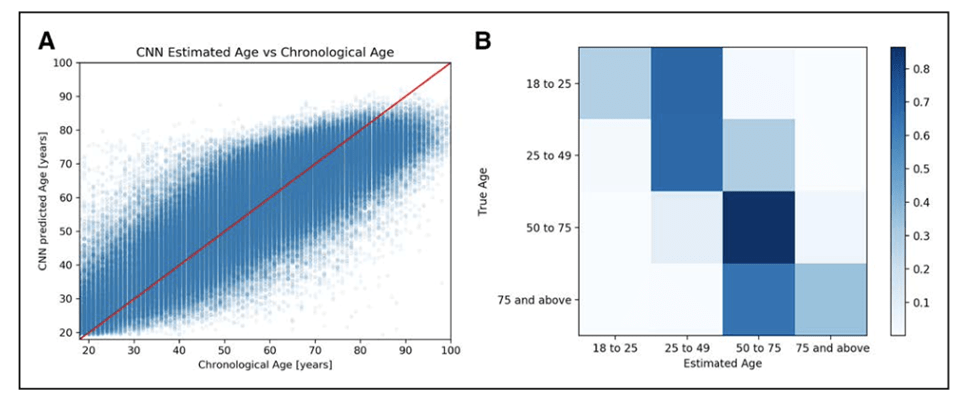
Ilustración 1: Edad predicha por la red neuronal convolucional (CNN) vs edad reportada. A, Se muestra la edad estimada predicha por la CNN a partir del ECG (en azul) frente a la edad cronológica reportada (en años; en rojo—línea de identidad). El R cuadrado del modelo fue 0.7 con una correlación de Pearson de r=0.837. B, Se demuestra una clasificación en múltiples grupos por edad (en años) en los grupos de 18 a 25, 25 a 50, 50 a 75, y 75 años y la precisión de la edad predicha por la CNN (eje x—edad estimada) frente a la edad real (eje y) en términos del porcentaje de pacientes con una edad real específica que tenían una edad predicha por la CNN correspondiente dentro de un rango similar (por ejemplo, un paciente de 18 a 25 años de edad teniendo una edad predicha por la CNN de 18 a 25 años). Imagen tomada de Circ Arrhythm Electrophysiol. 2019 Sep;12(9).
Tabla 1.
| Diagnóstico Disfunción ventricular izquierda Falla cardiaca con fracción de eyección preservada Estenosis válvula aórtica Hipertensión pulmonar Hipertrofia del ventrículo izquierdo Infarto agudo de miocardio con o sin elevación ST Arritmias Hiperkalemia Anemia | Predicción Paroxismos de fibrilación auricular Deterioro de paciente y parada cardiaca Estenosis valvular aórtica Falla cardiaca con fracción de eyección preservada Regurgitación de válvula mitral. |
(Adaptada de European Heart Journal (2021) 42, 2896–2898 doi:10.1093/eurheartj/ehab090)
Otra condición en la que se han entrenado modelo ECG+IA es en la disfunción diastólica y las presiones de llenado elevado del ventrículo izquierdo. Las mediciones de las presiones se pueden estimar con métodos no invasivos, como el ecocardiograma, identificando parámetros específicos como la relación E/e’.
Esta es una condición que se asocia con el desarrollo de falla cardiaca incluso cuando en el examen evidencie una fracción de eyección preservada. Lee y cols, desarrollaron un modelo de ECG+IA para detectar disfunción diastólica y aumento de la presión de llenado cardíaco. El modelo fue entrenado, validado y probado con 98,736, 21,963 y 98,763 pacientes, respectivamente. El modelo fue evaluado utilizando el área bajo la curva (AUC) de la curva ROC, y su rendimiento pronóstico se comparó con la ecocardiografía. El AUC para detectar una presión de llenado aumentada fue de 0.911. Los AUCs para identificar grados de disfunción diastólica ≥1, ≥2 y 3 fueron 0.847, 0.911 y 0.943, respectivamente.
En el seguimiento los pacientes con presión de llenado elevado predicha por el AI-ECG, tuvieron una mayor mortalidad que aquellos con presión de llenado normal, de manera similar a aquellos con presión de llenado elevado diagnosticada con ecocardiograma convencional.
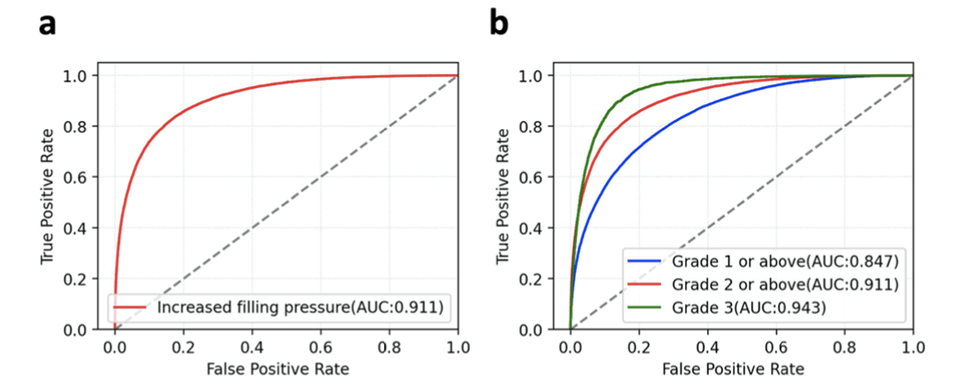
Ilustración 2: Curvas ROC del ECG+IA para la clasificación de la función diastólica y la presión de llenado. a Curva ROC para la detección de presión de llenado aumentada. b Curvas ROC para la detección de grados de función diastólica utilizando una escala ordinal. ROC, característica operativa del receptor; AUC, área bajo la curva. Tomado de npj Digital Medicine (2024)7:4 ; https://doi.org/10.1038/s41746-023-00993-7.
EKG+IA más allá de la cardiología
Tiene toda la lógica la implementación de modelos de ECG+IA aplicada en cardiología. Sin embargo, la ECG+IA ha sido capaz de predecir afecciones renales y hepáticas, así como el riesgo de enfermedades neurodegenerativas, como el Alzheimer, proporcionándonos un enfoque más holístico en pro de mejorar los beneficios de las herramientas actuales. En el caso de la enfermedad renal, para poner en contexto, debemos tener en cuenta que la enfermedad renal se asocia con trastornos electrolíticos, sobrecarga de líquidos en el cuerpo, e hipertensión arterial. También la ERC se relaciona con disfunción diastólica, hipertrofia ventricular, arritmias, falla cardiaca y un riesgo mayor de mortalidad cardiovascular. Otras anormalidades subclínicas como la fibrosis miocárdica también se pueden presentar en la ERC. Todas estas condiciones se pueden ver reflejadas en el registro eléctrico del corazón, sin embargo son cambios sutiles que pueden ser identificados con ECG+IA.
Modelos de IA en la enfermedad renal crónica
Kwon y Cols desarrollaron un modelo con una corte retrospectiva en 2 hospitales, donde se incluyeron 115,361 pacientes que tuvieran al menos un ECG tomado y una medición de tasa de filtración glomerular con una creatinina realizada en un tiempo no mayor de 30 minutos de realizado el ECG. La IA desarrollada fue un «Deep Learning Model» (DLM), usando 96,549 ECG de 55,222 pacientes. La validación interna incluyó 22,949 ECG del mismo número de pacientes. La validación externase realizó con 37,190 ECG del mismo número de pacientes. El desenlace final fue detectar deterioro de la función renal (DFR) de moderada a severa, estimada como una tasa de filtración glomerular menor de 45 mL/min/1.73m2. La AUC del DLM usando un ECG de 12 derivaciones para detectar DFR durante la validación interna y externa fue 0.858 (95% IC 0.851-0.866) y 0.906 (0.900-0.912), respectivamente.
En otro estudio Holmstrom y cols describieron el potencial del uso ECG+IA en el tamizaje de lla ERC. La cohorte principal estudiada consistió en 111,370 pacientes e incluyó 247,655 ECG, de los cuales 100,233 fueron asignados aleatoriamente al grupo de entrenamiento y 11,137 al grupo de prueba. El modelo alcanzó una precisión de 0.767 en el cohorte principal y de 0.709 en un cohorte de validación externa. La precisión fue mayor en etapas más avanzadas de la enfermedad renal crónica (ERC) y en pacientes más jóvenes.
Sin embargo, a pesar de estos avances emocionantes, el uso de IA en la interpretación del ECG y en el diagnóstico de enfermedades plantea desafíos éticos y técnicos significativos. La validación de estos modelos en poblaciones diversas y la transparencia en los algoritmos son esenciales para evitar sesgos que puedan llevar a diagnósticos incorrectos o a un mal uso de la tecnología. Además, es fundamental garantizar que los modelos sean auditables y explicables, para que los clínicos puedan confiar en sus resultados y tomar decisiones informadas.
En conclusión, el ECG+IA está revolucionando la medicina moderna no solo optimizando la detección y el manejo de enfermedades cardíacas, sino que también está ampliando el espectro del ECG a otras especialidades médicas. El futuro apunta hacia un enfoque en el ECG+IA podrían jugar un papel crucial en la detección temprana de condiciones subclínicas en cardiología y otras especialidades clínicas además de un enfoque predictivo redefiniendo el alcance de la atención médica y mejorando los resultados para los pacientes.
Para quienes deseen explorar más les recomiendo ver la discusión de este tema en el club de revista disponible en nuestro canal de youtube: https://youtu.be/iO7bzju2emk?si=mPJDjUvxO9ujgbBQ
LECTURAS RECOMENDADAS
- Attia ZI, Friedman PA, Noseworthy PA, Lopez-Jimenez F, Ladewig DJ, Satam G, Pellikka PA, Munger TM, Asirvatham SJ, Scott CG, Carter RE, Kapa S. Age and Sex Estimation Using Artificial Intelligence From Standard 12-Lead ECGs. Circ Arrhythm Electrophysiol. 2019 Sep;12(9):e007284. doi: 10.1161/CIRCEP.119.007284. Epub 2019 Aug 27. PMID: 31450977; PMCID: PMC7661045.
- Kooman JP. Detecting chronic kidney disease by electrocardiography. Commun Med (Lond). 2023 May 26;3(1):74. doi: 10.1038/s43856-023-00306-9. PMID: 37237030; PMCID: PMC10219928.
- Kwon JM, Kim KH, Jo YY, Jung MS, Cho YH, Shin JH, Lee YJ, Ban JH, Lee SY, Park J, Oh BH. Artificial intelligence assessment for early detection and prediction of renal impairment using electrocardiography. Int Urol Nephrol. 2022 Oct;54(10):2733-2744. doi: 10.1007/s11255-022-03165-w. Epub 2022 Apr 11. PMID: 35403974; PMCID: PMC9463260.
- Kwon JM, Jo YY, Lee SY, Kim KH. Artificial intelligence using electrocardiography: strengths and pitfalls. Eur Heart J. 2021 Aug 7;42(30):2896-2898. doi: 10.1093/eurheartj/ehab090. PMID: 33748841; PMCID: PMC8347448.
- Lee, E., Ito, S., Miranda, W.R. et al. Artificial intelligence-enabled ECG for left ventricular diastolic function and filling pressure. npj Digit. Med. 7, 4 (2024).
