Autora: Ivana Frías – Miembro AIpocrates
La toma de decisiones representa un reto cognitivo para el profesional clínico, ya que demanda de habilidades, conocimientos y formación en medicina basada en evidencias, junto con la aplicación de una metodología ordenada y precisa (1). En este complejo proceso el razonamiento clínico emerge como una herramienta fundamental, permitiendo una comprensión profunda de la información clínica proporcionada por el paciente durante el interrogatorio o anamnesis. Asimismo, facilita la interpretación de hallazgos en la exploración física y, cuando es necesario, de pruebas complementarias (2). Este proceso mental constituye el cimiento sobre el cual se establecen los diagnósticos y se seleccionan los planes de tratamiento.
La Incertidumbre en la Práctica Médica: Navegando entre Decisiones, Diagnósticos y Razonamiento Clínico
El clínico, a lo largo de su ejercicio médico, se ha enfrentado a la incertidumbre, aquella carencia de certeza o imposibilidad de prever con seguridad los resultados relacionados a la salud de un paciente. La cultura médica desempeña un papel crucial en la actitud adoptada hacia la incertidumbre, ya que algunas perspectivas dentro de la profesión rechazan el error y no reconocen la imposibilidad de alcanzar la perfección en el diagnóstico y la toma de decisiones terapéuticas.
A pesar de los avances científicos y tecnológicos en el campo de la salud, existen factores que pueden contribuir a la incertidumbre, como la complejidad de algunas enfermedades, la variabilidad individual de los pacientes, las limitaciones de recursos y la falta de información o experiencia. En estos escenarios la incertidumbre está estrechamente vinculada al razonamiento clínico, ya que los profesionales deben enfrentarse a situaciones donde la información disponible es limitada, ambigua o sujeta a la interpretación. El razonamiento clínico efectivo implica la habilidad de manejar y gestionar la incertidumbre de manera reflexiva, tomando decisiones informadas basadas en la mejor evidencia disponible y la experiencia clínica. Este proceso solo será válido cuando se sustente en nociones y hechos precisos; de lo contrario, los resultados estarán propensos a errores (3).
Para lograr un diagnóstico médico con base en el razonamiento, es esencial fundamentarse en premisas clave como la calidad de la relación paciente-clínico, la información recopilada durante la anamnesis, la exploración física y la correlación entre signos y síntomas para la integración de síndromes (4). En ocasiones se suele requerir de pruebas complementarias (laboratorios, estudios anatomopatológicos y de imagen) o en casos más complejos de interconsultas y referencias a otros niveles de atención (5).
Realizar un diagnóstico preciso es importante, puesto que brinda explicación de los problemas de salud de un paciente y determina las conductas a seguir en la atención médica (6). Además, la relevancia de un diagnóstico correcto se extiende a la prevención de enfermedades o complicaciones, la detección temprana de patologías, y la determinación de pronóstico y tratamiento.
SARC: Más Allá de la Decisión, Hacia el Razonamiento Clínico Avanzado
En la constante evolución de la práctica médica, donde la toma de decisiones y el razonamiento clínico son pilares esenciales, emerge un horizonte transformador impulsado por los avances tecnológicos. La integración de los sistemas de apoyo a la decisión clínica (SADC) respaldados por la inteligencia artificial (IA), se presentan como el aliado que redefine la forma en que los profesionales de la salud enfrentan los desafíos diagnósticos y terapéuticos (Figura 1).

Figura 1. Sistemas de Apoyo al Razonamiento Clínico
Los SADC son esencialmente programas informáticos diseñados para auxiliar al personal sanitario facilitando la adquisición de conocimientos y el proceso de toma de decisiones, ya sean preventivas, diagnósticas o terapéuticas (7). Su finalidad principal radica en disminuir la incertidumbre y los errores intrínsecos a este proceso, facilitando así las labores diarias y elevando la calidad de los servicios prestados (8).
En la actualidad se han descrito en la literatura relevante dos tipos de SDAC: “SDAC basados en el conocimiento” y “SDAC no basados en el conocimiento” (9, 10). Los SDAC basados en el conocimiento están compuestos por una base de datos, un motor de inferencia y un sistema de comunicación, y generalmente operan mediante reglas “if-then”. Por otra parte, los SDAC no basados en el conocimiento emplean la IA, el aprendizaje automático (ML: machine learning) o el reconocimiento de patrones estadísticos para analizar la información clínica con enfoques de aprendizaje supervisado y no supervisado (11). El aprendizaje supervisado implica entrenar al modelo con un conjunto de datos que poseen pares etiquetados de entrada y salida. Algunas de las técnicas empleadas incluyen la regresión logística, la regresión lineal, el árbol de decisiones y las redes neuronales (12). En contraste, el aprendizaje no supervisado utiliza datos de entrada sin etiquetas de salida, pero el algoritmo tiene la capacidad de identificar patrones y relaciones entre los datos. Las técnicas utilizadas en este enfoque comprenden la agrupación en clúster, el aprendizaje de reglas de asociación, la densidad de probabilidad y la reducción de dimensionalidad (12).
La complejidad inherente a los SDAC, con el objetivo de proporcionar un respaldo efectivo a las tareas cognitivas, ha llevado a una reconsideración de su propia denominación. Esto sugiere la necesidad de un diseño específico que considere los aspectos relacionados con la teoría del conocimiento y la manera en que los profesionales clínicos adquieren y emplean información durante el proceso de toma de decisiones. Este enfoque proporciona una perspectiva fascinante al contemplar estos sistemas no solo como instrumentos de decisión, sino como auxiliares para el razonamiento clínico, identificándolos como sistemas de apoyo al razonamiento clínico (SARC) (13).
Explorando el Papel de la Inteligencia Artificial en los SARC para el Diagnóstico Médico
Debido al reto que confiere establecer un diagnóstico se han desarrollado los sistemas de apoyo a las decisiones diagnósticas (SADD) (14), que por la complejidad que requiere este proceso cognitivo las podríamos denominar “sistemas de apoyo al razonamiento diagnóstico” (SARD).
Estos sistemas suelen ofrecer una especie de «asesoramiento» computarizado o una etapa de filtrado, donde se reciben datos o elecciones por parte del usuario, y posteriormente generan una lista de posibles diagnósticos diferenciales (14). Anteriormente, los SARD no habían tenido el éxito que se esperaba comparados con otras clases de SARC, esto debido a los sesgos y la percepción negativa por parte del gremio, la falta de precisión (causada en parte por la limitada disponibilidad de datos) y la poca integración efectiva del sistema, que requería la introducción manual de información. No obstante, gracias a los avances en IA se han mejorado significativamente mediante la incorporación de registros médicos electrónicos y la entrada de órdenes médicas computarizadas. En la actualidad, observamos el desarrollo de SARD que emplean técnicas no basadas en el conocimiento, como el ML, lo cual puede abrir el camino para lograr diagnósticos más precisos (14).
Los SARD encuentran aplicaciones en diversas áreas incluyendo el diagnóstico a través de imágenes, laboratorio y estudios anatomopatológicos. Empresas destacadas en este ámbito, como IBM Watson Health, DeepMind y Google, están dedicadas al desarrollo de productos que mejoran el diagnóstico por imágenes. Estos productos se centran en aplicaciones para la detección de tumores, interpretación de imágenes médicas, diagnóstico de retinopatía diabética y utilizan aprendizaje multimodal de características para el diagnóstico de la enfermedad de Alzheimer, entre otros casos. En cuanto al diagnóstico mediante pruebas de laboratorio, se están desarrollando modelos de inteligencia artificial que combinan múltiples pruebas, como marcadores séricos, imágenes y pruebas genéticas, para enfermedades como hepatitis B y C, interpretación de gasometría arterial, informes de electroforesis de proteínas y recuento de células sanguíneas (14). Además, en patología se utiliza la clasificación automatizada de tumores.
El Futuro de la Atención Médica: Integración de SARC y los GPT
Además de los avances en los SARC, otro desarrollo notable en la intersección de la tecnología y la atención médica es la implementación de chatbots y su evolución: los transformadores generativos preentrenados (GPTs). A diferencia de los SARC, que se centran en proporcionar recomendaciones especializadas para la toma de decisiones clínicas, los chatbots son programas informáticos impulsados por IA y procesamiento del lenguaje natural (NLP) diseñados para interactuar con usuarios de manera conversacional.
Un chatbot consta de dos componentes principales: un sistema de IA de propósito general y una interfaz de chat (15). Al utilizar un chatbot, el usuario inicia “sesión” mediante una consulta o “prompt”, en lenguaje natural. El chatbot responde de manera inmediata, creando una interacción continua que simula una conversación humana para proporcionar una experiencia más útil y natural. Estos chatbots han impulsado la evolución de los GPTs, modelos de lenguaje largo (LLM) que se entrenan con cantidades masivas de datos para predecir con precisión qué palabra viene a continuación en una oración. Pueden comprender y generar texto de manera similar a un humano. En los entornos de chat, el GPT opera como un asistente virtual capaz de responder preguntas, generar respuestas y mantener conversaciones con los usuarios de forma natural. A medida que más personas interactúan con GPT en chats, su capacidad para ofrecer respuestas precisas y coherentes mejora progresivamente.
Gracias a su capacidad para procesar grandes cantidades de datos y detectar patrones y tendencias más allá de la capacidad humana, estos modelos de IA generativa (IAgen) ofrecen diagnósticos más rápidos y precisos, así como opciones de tratamiento personalizadas. Este análisis se realiza mediante la evaluación de imágenes médicas, registros médicos electrónicos y datos del paciente, como historial médico, síntomas y composición genética (16). Al mismo tiempo, al comprender preguntas y proporcionar respuestas automatizadas, desempeñan un papel valioso en la atención médica, facilitando la interacción entre pacientes y sistemas de salud, respondiendo consultas, suministrando información sobre medicamentos y recordatorios de citas, y contribuyendo a la gestión de la salud del paciente.
La combinación de los SARC, que ofrecen apoyo especializado a los profesionales de la salud, con la presencia de GPTs que mejoran la interacción con los pacientes, representa un enfoque integral para mejorar la eficiencia y la calidad en la prestación de servicios de atención médica. Esta convergencia de tecnologías ofrece un panorama prometedor para la transformación digital en el sector de la salud, mejorando tanto la toma de decisiones clínicas como la experiencia del paciente. Esta combinación de tecnologías promete mejorar la eficiencia y la calidad en la prestación de servicios médicos, brindando beneficios tanto para los pacientes como para los profesionales de la salud.
AMIE: Redefiniendo la Relación Médico-Paciente con Conversaciones Impulsadas por la IA
La comunicación médico-paciente es un pilar fundamental en la medicina, donde la habilidad de los clínicos para establecer diálogos eficaces impulsa diagnósticos, gestión, empatía y confianza. ¿Qué pasaría si pudiéramos contar con sistemas de IA capaces de participar en estos diálogos diagnósticos, mejorando la disponibilidad y calidad del cuidado? Este es el desafío que aborda Google con su más reciente desarrollo “Articulate Medical Intelligence Explorer” (AMIE), una IAgen basada en LLM para optimizar el razonamiento médico y las conversaciones diagnósticas. Aunque los LLM han demostrado habilidades en el lenguaje natural, adaptarlos a la complejidad única de los diálogos diagnósticos médicos es un desafío considerable (Figura 2).
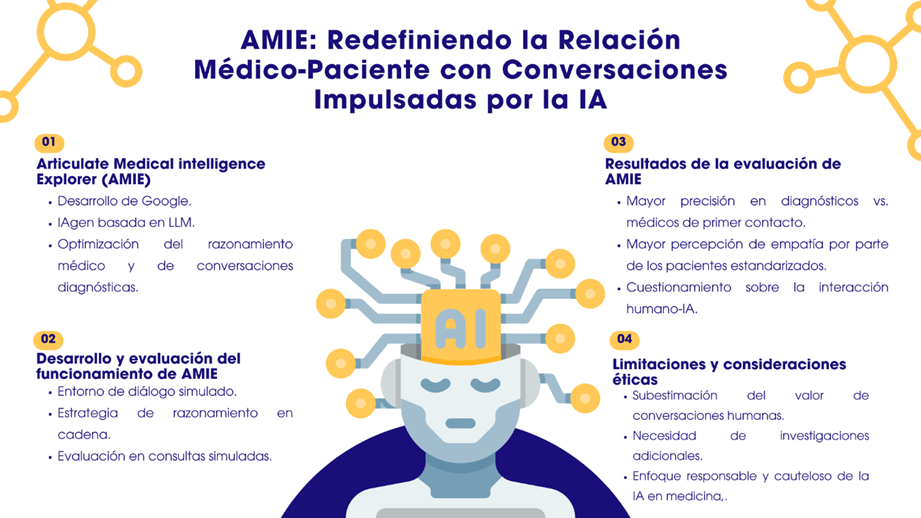
Figura 2. AMIE: Redefiniendo la relación médico-paciente con conversaciones impulsadas por IA
El equipo detrás de AMIE abordó esta brecha creando un entorno de diálogo simulado basado en autojugabilidad, enriqueciendo y acelerando el aprendizaje del sistema. Además, se implementó una estrategia de razonamiento en cadena durante la inferencia, mejorando la precisión diagnóstica y la calidad de la conversación.
La evaluación de AMIE se llevó a cabo en simulaciones de consultas entre actores-pacientes y médicos de atención primaria, utilizando un enfoque aleatorio y a ciegas. Sorprendentemente, AMIE demostró una mayor precisión en sus diagnósticos en comparación con los médicos sin asistencia, los médicos asistidos mediante búsqueda y los médicos asistidos por AMIE (17). Sin embargo, lo que resulta aún más interesante es que AMIE fue percibido con un trato más empático por los pacientes que los propios médicos. Esto plantea la pregunta: ¿qué estamos haciendo mal en nuestra interacción humana para que una inteligencia artificial sea percibida como más comprensiva que un ser humano?
Aunque este avance es prometedor, es crucial tener en cuenta las limitaciones y la necesidad de investigaciones adicionales. La evaluación, realizada en un entorno de texto chat, puede subestimar el valor de las conversaciones humanas en la práctica clínica real.
Este trabajo representa una exploración temprana del potencial de la IA en el ámbito médico, subrayando la necesidad de un enfoque responsable y cauteloso. La IA, aunque prometedora, debe abordar desafíos significativos antes de integrarse completamente en la práctica clínica. AMIE es un proyecto de investigación experimental que busca visualizar un futuro donde la IA sea un aliado seguro y accesible para los clínicos en la toma de decisiones diagnósticas y conversaciones médicas.
Conclusiones
Los modelos de IA pueden ayudar a ofrecer una mejor atención al paciente al reducir el error humano, personalizar los planes de tratamiento y mejorar los diagnósticos.
Con la capacidad de la IA para procesar y analizar grandes cantidades de datos, los proveedores de atención médica pueden hacer diagnósticos más precisos, lo que puede conducir a tiempos de tratamiento y recuperación más rápidos para los pacientes. Se pueden desarrollar planes de tratamiento personalizados utilizando algoritmos de IA, lo que da como resultado terapias dirigidas adaptadas a las necesidades únicas de cada paciente. Esto mejora la experiencia del paciente y puede conducir a mejores resultados de salud.
Sin embargo es esencial examinar de cerca esta interacción, especialmente cuando se trata de tecnologías como los GPTs y sistemas de IAgen. El diseño de herramientas médicas no debe subestimarse, ya que su impacto va más allá de la eficacia técnica, afectando directamente la confianza en la tecnología y la seguridad de los pacientes. Un diseño deficiente o una interpretación incorrecta de datos por parte de estas herramientas pueden resultar en diagnósticos erróneos o recomendaciones de tratamiento inapropiadas. La confianza ciega en la tecnología, sin la evaluación crítica y supervisión continua por parte de los médicos, podría acarrear consecuencias perjudiciales para la salud de los pacientes. Es esencial reconocer que cualquier error en el proceso de diagnóstico puede desencadenar diagnósticos tardíos, incorrectos u omitidos. Asimismo los errores en el diagnóstico generan angustia psicológica y costos financieros significativos.
La responsabilidad ética en el diseño y uso de estas tecnologías se vuelve fundamental para evitar consecuencias perjudiciales y garantizar resultados precisos y seguros para los pacientes. La transparencia en la toma de decisiones de la IA y la consideración de posibles sesgos son elementos cruciales. Los diseñadores deben ser conscientes de los posibles impactos negativos y trabajar para mitigar cualquier riesgo asociado con estas tecnologías.
Estas herramientas son valiosas para complementar la toma de decisiones y el razonamiento clínico, pero no deben considerarse como un reemplazo del médico; más bien, ambas partes deben interactuar de manera armoniosa (imagen 1).

Imagen 1.
Referencias
- Novás, J., Machado, B., & González, A. L. (2006). El diagnóstico médico: Bases y procedimientos. Rev Cubana Med Gen Integr, 22. https://scholar.archive.org/work/cm2m4csc2rgabajqc3brj5tf6i
- Balogh, E. P., Miller, B. T., Ball, J. R., Care, C. on D. E. in H., Services, B. on H. C., Medicine, I. of, & The National Academies of Sciences, E. (2015). The Diagnostic Process. En Improving Diagnosis in Health Care. National Academies Press (US). https://www.ncbi.nlm.nih.gov/books/NBK338593/
- Holmboe, E. S., & Durning, S. J. (2014). Assessing clinical reasoning: moving from in vitro to in vivo. Diagnosis (Berlin, Germany), 1(1), 111–117. https://doi.org/10.1515/dx-2013-0029
- Hak, F., Guimarães, T., & Santos, M. (2022). Towards effective clinical decision support systems: A systematic review. PloS one, 17(8), e0272846. https://doi.org/10.1371/journal.pone.0272846
- Gunaratnam, M., Frize, M., & Bariciak, E. (2012). Conceptual Framework for A Perinatal Decision Support System using a Knowledge-Based Approach. CMBES Proceedings, 35. https://proceedings.cmbes.ca/index.php/proceedings/article/view/674
- Ho, K. F., Chou, P. H., Chao, J. C., Hsu, C. Y., & Chung, M. H. (2021). Design and evaluation of a knowledge-based clinical decision support system for the psychiatric nursing process. Computer methods and programs in biomedicine, 207, 106128. https://doi.org/10.1016/j.cmpb.2021.106128
- Kim, S., Kim, E. H., & Kim, H. S. (2022). Physician Knowledge Base: Clinical Decision Support Systems. Yonsei medical journal, 63(1), 8–15. https://doi.org/10.3349/ymj.2022.63.1.8
- Aprendizaje supervisado frente a aprendizaje no supervisado: Diferencia entre los algoritmos de machine learning – AWS. (s/f). Amazon Web Services, Inc. Recuperado el 22 de enero de 2024, de https://aws.amazon.com/es/compare/the-difference-between-machine-learning-supervised-and-unsupervised/
- Pino, L. E. (2021, febrero 24). Sistemas de Apoyo al Razonamiento Clínico desde la IA (Contexto Local). consultorsalud. https://consultorsalud.com/sistemas-de-apoyo-al-razonamiento-clinico/
- Sutton, R. T., Pincock, D., Baumgart, D. C., Sadowski, D. C., Fedorak, R. N., & Kroeker, K. I. (2020). An overview of clinical decision support systems: Benefits, risks, and strategies for success. Npj Digital Medicine, 3(1), Article 1. https://doi.org/10.1038/s41746-020-0221-y
- Lee, P., Bubeck, S., & Petro, J. (2023). Benefits, Limits, and Risks of GPT-4 as an AI Chatbot for Medicine. New England Journal of Medicine, 388(13), 1233–1239. https://doi.org/10.1056/NEJMsr2214184
- Biswas, S. (2023, junio 28). The Promises and Pitfalls of AI in Medicine with ChatGPT | GJIA. Georgetown Journal of International Affairs. https://gjia.georgetown.edu/2023/06/28/revolutionizing-healthcare-the-promises-and-pitfalls-of-ai-in-medicine-with-chatgpt/
- Tu, T., Palepu, A., Schaekermann, M., Saab, K., Freyberg, J., Tanno, R., Wang, A., Li, B., Amin, M., Tomasev, N., Azizi, S., Singhal, K., Cheng, Y., Hou, L., Webson, A., Kulkarni, K., Mahdavi, S. S., Semturs, C., Gottweis, J., … Natarajan, V. (2024). Towards Conversational Diagnostic AI (arXiv:2401.05654). arXiv. http://arxiv.org/abs/2401.05654
